GÁS IDEAL
Todo o gás em condições que possamos desprezar as forças intermoleculares. Em geral em uma pressão baixa e uma alta temperatura.
Um gás ideal é descrito pela equação:
PV = nRT, denominadas variáveis ou funções de estado, onde:
P= pressão;
V= volume;
n= número de mols;
R= constante (a unidade do problema define o valor de R, ex: 0,082, 8,314, etc.)
T= temperatura.
Uma Equação de Estado pode ser definida como uma relação entre as variáveis de estado. Num sistema gasoso no mínimo duas destas variáveis serão modificadas.
Pressão: em um gás , a pressão é decorrência das colisões entre as suas moléculas e as paredes do recipiente no qual se encontra.
EQUILÍBRIO MECÂNICO:
SISTEMA FECHADO COM PAREDES MÓVEIS:

No equilíbrio mecânico:
P = PExterna
VOLUME,V:
Unidades:
m3 = SI
cm3 = mL
L = dm3
TEMPERATURA, T:
Unidade:
T: Kelvin (K)
t: 0C
T: é uma medida da energia cinética média das moléculas (microscopicamente)
"grau de aquecimento do sistema " (macroscopicamente, informal)
Ѳ: sem se referir a temperatura específica, usa-se téta.
QUANTIDADE DE MATÉRIA, n:
n = m
M
1 mol = 6,02 x 1023 unidades (número de Avogadro)
CONSTANTE UNIVERSAL DOS GASES, R:
R = 8,314 Pa.m3 / K.mol → 8,314 J / K.mol
R = 1,987 cal / K.mol
R = 0,082 atm.L / K.mol
R = 62,36 mmgH.L /K.mol
CONCENTRAÇÃO MOLAR (C)E VOLUME MOLAR:
Concentração molar → c = n ÷ v
G.I. → PV = Nrt → P = n RT → P = CRT → C = P
V RT
Volume molar: volume ocupado por um mol.
Ṽ = V / n → então → C = 1 / V ou Ṽ = 1 / C
Quanto maior a concentração do gás, menor o volume molar (Van Der Walls)
PROPRIEDADE EXTENSIVA E INTENSIVA:
1a) Propriedade extensiva: qualquer propriedade que dependa da extensão do sistema.
Ex: V, n,
2a) Propriedade intensiva: qualquer propriedade que não dependa da extensão do sistema.
Ex: T, P,
Muitas vezes, uma propriedade intensiva é a razão de duas extensivas.
Ex: Densidade, C, Ṽ
d = m / V → Ṽ = V / n
Sistema: é a parte do universo que se encontra em investigação.
Vizinhança (meio-externo): é o que rodeia os sistema, o restante do universo;
Universo: é o sistema mais o meio externo.
Fronteiras ou paredes: são os limites físicos entre sistema e meios externo. Podem ser: rígidas ou móveis; adiabáticas (isolantes térmicas, não existe troca de calor); diatérmicas (condutoras de calor).
SISTEMA, VIZINHANÇA, PAREDES E TRANSFORMAÇÕES
Vizinhança (meio-externo): é o que rodeia os sistema, o restante do universo;
Universo: é o sistema mais o meio externo.
Fronteiras ou paredes: são os limites físicos entre sistema e meios externo. Podem ser: rígidas ou móveis; adiabáticas (isolantes térmicas, não existe troca de calor); diatérmicas (condutoras de calor).
Tipos de sistemas e transformações
Sistema isolado: paredes rígidas e adiabáticas; não interage com o meio externo, portanto, não pode sofrer nenhuma transformação.
Sistema adiabático: paredes móveis e adiabáticas;
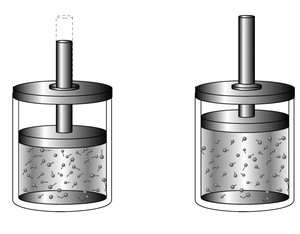
Quando o êmbolo baixa a Temperatura aumenta e quando o êmbolo sobe a Temperatura diminui. P,V e T sofrem alterações nas transformações adiabáticas (não há troca de calor entre o sistema e o meio externo)
Para os gases ideais:


Sistema adiabático: paredes móveis e adiabáticas;

Quando o êmbolo baixa a Temperatura aumenta e quando o êmbolo sobe a Temperatura diminui. P,V e T sofrem alterações nas transformações adiabáticas (não há troca de calor entre o sistema e o meio externo)
Para os gases ideais:
P2V2
= P1V1
T2 T1
Sistema fechado e rígido: paredes diatérmicas rígidas. P e T sofrem transformações.

A garrafa com água é um exemplo de um sistema fechado, já que esta pode sofrer transformações de P e T.
Este sistema sofre transformações isométricas (isocóricas).
Para os gases ideais:
P2
= P1
T2 T1
Sendo diretamente proporcionais, se a P aumenta a T aumenta na mesma proporção.Sistema fechado flexível: paredes diatérmicas móveis.
LEI ZERO DA TERMODINÂMICA
Se dois corpos 1 e 2 encontram-se em equilíbrio térmico com um terceiro corpo 3, então 1 e 2 estão em equilíbrio térmico entre si.
Temperatura, (Ѳ, téta): propriedade que indica o equilíbrio térmico entre dois corpos. Igualdade de T, indica que os corpos estão em equilíbrio térmico.
Temperatura, (Ѳ, téta): propriedade que indica o equilíbrio térmico entre dois corpos. Igualdade de T, indica que os corpos estão em equilíbrio térmico.
Nenhum comentário:
Postar um comentário